Reactivo limitante y reactivo en exceso
Analicemos la siguiente analogía:
En
la cafetería de Artes tienen una “ecuación” para preparar pan con
jamón. Ellos requieren de 1 jamón y 2 rebanadas de pan de molde, por
cada pan con jamón que deban preparar.
La “ecuación” la podemos representar de la siguiente forma:
1 JAMÓN + 2 REBANADAS DE PAN --> 1 “PAN CON JAMÓN"
Analicen y respondan las situaciones siguientes:
1. Si se cuenta con 15 jamones y:
- 38 rebanadas de pan, ¿cuántos panes con jamón se podrán preparar?, ¿sobrará alguna pieza? ¿cuántas?
- 28 rebanadas de pan, ¿cuántos panes con jamón se podrán preparar?, ¿sobrará alguna pieza? ¿cuántas?
2. En el punto 1, establece para cada situación, quién limita la producción de panes con jamón, las rebanadas de pan o el jamón. Es decir quién es el “reactivo limitante” para cada situación.
Una vez analizada la analogía anterior, podemos tener ya una idea y una definición de reactivo limitante. Escribela y luego compara tus observaciones con las emitidas líneas abajo.
- El reactivo limitante será aquél que se agote primero en la reacción.
- El reactivo en exceso será aquel que no se agote por completo durante la reacción.
- La cantidad de producto que se obtenga de la reacción, dependerá siempre de la cantidad de reactivo limitante que se tenga en la reacción.
El
video muestra distintos casos para la reacción entre magnesio (Mg) y
ácido clorhídrico (HCl), donde se forma cloruro de magnesio (MgCl2) e hidrógeno gaseoso (H2).
- Escribe la ecuación quimica balanceada que se está planteando en el experimento.
- Observa detenidamente lo que ocurre en cada uno de los recipientes donde ocurre la reacción.
- Lo observado tiene relación con la definición de reactivo limitante, ¿puedes agregar algo más a la definidión dada anteriormente?
El siguiente vídeo muestra otros casos similares sobre el reactivo limitante (observación: el video está en inglés pero se puede seguir mediante las reacciones indicadas en el mismo):
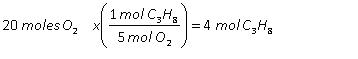
No hay comentarios:
Publicar un comentario