Características de los ácidos y bases
Las características de los ácidos y bases son todas aquellas propiedades y cualidades con las que podemos distinguir entre un ácido y una base.
Según la teoría de Arrehnius, un ácido es una sustancia que libera protones H+ cuando se disuelve en agua, y una base es cualquier sustancia que libera iones hidroxilo OH- cuando se encuentra en solución acuosa.
| Ácidos | Bases | |
|---|---|---|
| Formación de iones | Presente | Presente |
| Reacción de neutralización | Cuando reacciona con una base. | Cuando reacciona con un ácido. |
| Solubilidad en agua | Solubles | Parcialmente solubles. Hidróxidos de calcio, bario y aluminio son poco solubles. |
| Conductividad eléctrica | Presente | Presente |
| Estado de la materia | Sólido, líquido o gaseoso | Sólido, líquido o gaseoso |
| Reacción con el papel tornasol | Coloración roja | Coloración azul |
| Valor de pH | Menor de 7 | Mayor de 7 |
| Contraparte conjugada | Un ácido débil forma una base conjugada. | Una base débil forma un ácido conjugado. |
| Efecto corrosivo | Ácidos fuertes | Bases fuertes |
Características de los ácidos
Los ácidos presentan varias características con las cuales pueden identificarse.
Capacidad de formar iones de los ácidos
La principal característica de las sustancias ácidas es que se pueden ionizar, es decir, perder o ganar electrones.
El ácido clorhídrico HCl, un ácido fuerte, se ioniza para formar anión cloruro Cl- y protón H+.
![]()
Reacción de neutralización
Un ácido reacciona con una base para formar una sal y agua. A esta reacción se le conoce como reacción de neutralización. Por ejemplo, el HCl reacciona con el NaOH para formar cloruro de sodio NaCl (sal de cocina) y agua:
![]()
Solubilidad en agua de los ácidos
Los ácidos por lo general, son solubles en agua. Por ejemplo, el ácido clorhídrico o ácido muriático es moderadamente soluble en agua, se puede disolver hasta 82 gr de HCl en 100 ml de agua a 0ºC. En el caso del ácido sulfúrico H2SO4, la mezcla con agua genera calor, por lo que siempre es recomendable añadir el ácido al agua para evitar explosiones.
Fuerza de los ácidos
La forma cómo los ácidos se disocian determina si son fuertes o débiles. La fuerza de un ácido está dada por su constante de disociación.
El ácido nítrico HNO3 es un ácido fuerte porque en solución acuosa se ioniza completamente en protones e iones nitrato:
![]()
Esto significa que cuando adicionamos HNO3 en agua, al analizar el agua sólo encontraremos H+ e iones nitrato, y prácticamente nada de HNO3.
En cambio, el ácido acético que se encuentra en el vinagre es un ácido débil, porque solo una parte de este se disocia:
![]()
Por eso se representa con flechas en doble sentido, esto quiere decir que en solución acuosa tendremos en equilibrio el ácido acético, el H+ y el anión acetato (H3C-COO-).
Estados de la materia de los ácidos
Los ácidos se pueden encontrar en estado líquido, sólido o gaseoso. Por ejemplo, el ácido clorhídrico HCl es líquido, el ácido sulfhídrico HS es un gas y el ácido oxálico es un sólido.
Reacción con el papel tornasol de los ácidos

Cuando colocamos una tira de papel tornasol en una sustancia ácida, el papel tornasol cambia a rojo.
Identificación de los ácidos por su pH
El pH es la medida de la cantidad de H+ presentes en una solución. Así, entre pH 0 y 7, estamos en presencia de un ácido. Por ejemplo, el vinagre tiene un pH igual a 2, el pH del ácido sulfúrico en las baterías de automóviles es igual a 1.
Conductividad eléctrica de los ácidos
Como los ácidos pueden disociarse y producir iones con cargas eléctricas, las soluciones ácidas pueden conducir la electricidad. Por ejemplo, dentro de las baterías de carros se usa ácido sulfúrico que es un ácido fuerte como conductor de electricidad.
Efecto corrosivo de los ácidos fuertes
Los ácidos fuertes tienen un efecto corrosivo, pueden quemar tejidos orgánicos por lo que su manejo debe ser extremadamente cuidadoso.
Ácidos débiles forman una contraparte conjugada
Los ácidos débiles al disolverse forman lo que se conoce como par conjugado, esto es, un ácido débil forma una base conjugada.
Por ejemplo:
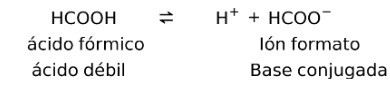
En este caso, el ácido fórmico o metanoico (HCOOH), al disociarse forma la base conjugada ión formato.
TAREA
REALICE UN MAPA CONCEPTUAL DEL TEMA
No hay comentarios:
Publicar un comentario