¿Qué es Una Sal?
Una sal se forma en la reacción química de un ácido y una base donde la base proporciona el catión, y el ácido el anión.
Por lo tanto una sal está formada por cationes (Iones con carga positiva) enlazados a aniones (iones con carga negativa) mediante un enlace iónico.
Una sal es un compuesto iónico.
Recuerda que un metal es un cation y un no metal es un anion no metalico.
Según esto para formar una sal necesitamos SAL = Metal + NO Metal
Acido + Base —> Sal + Agua
Como en el resultado de la reacción se forma agua H2O resulta que es porque el ácido dona un ión H+ y la Base.
La sal común, conocida popularmente como sal, es un tipo de sal denominada cloruro sódico (o cloruro de sodio), cuya fórmula química es NaCl.
Por lo general, se forma una sal neutra cuando hay un ácido fuerte y una base fuerte neutralizandose en la reacción.
La neutralización completa del ácido por la base lleva consigo la sustitución de todos los iones hidrógeno del ácido por el catión del hidróxido, formándose además agua en la reacción.
Puede considerarse como compuestos binarios (2 elementos) formados por un catión (proveniente de la base) y un anión (que proviene del ácido).
¿Qué es una Sal Neutra?
Sal neutra es una sal en la que el ácido y la base se neutralizan uno al otro.
Son compuestos ternarios constituidos por un no metal, oxígeno ymetal.
Se obtienen por neutralización total de un hidróxido sobre un ácido oxoácido.
La reacción que tiene lugar es:
ÁCIDO OXOÁCIDO + HIDRÓXIDO –> SAL NEUTRA + AGUA
Las sales neutras son compuestos formados por la reacción de un ácido con un hidróxido (compuesto ternario básico) formando también agua.
Entre las sales neutras se encuentran las binarias y las ternarias, que se diferencian entre si por el ácido con el que reaccionan, siendo estos un hidrácido o un oxácido.
Hidrácido + Hidróxido =====> Agua + Sal neutra
Ejemplo:
Si se combinan el Hidróxido de Sodio más el Ácido Nítrico forman la sal correspondiente mas el agua.
![]()
Otro ejemplo:
HCl + Na(OH)======> H2O + NaCl
Luego veremos muchos más ejemplos de sales neutras.
La formulación de las sales neutras siguen el siguiente modelo: MaNb, donde M: elemento metálico, N: elemento no metálico, a: valencia del elemento no metálico y b: valencia del elemento metálico.
Sales Neutras Ejemplos
Recuerda: Sales Neutras: resultado de sustituir todos los H+ del ácido por un metal.
Veamos muchos ejemplos de sales neutras.
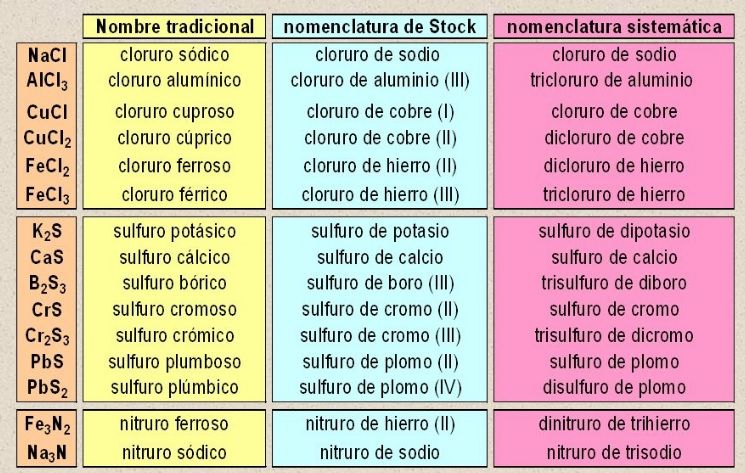
Primero empezamos por ver una tabla con varias sales neutras y como se nombran en los tres tipos de nomencalturas diferentes.
Luego veremos ejemplos nombrados de diferentes formas.
HCl + NaOH → NaCl + H2O
H2SO4 + 2 Fe(OH)3 → Fe2(SO4)3 + 6 H2O
NaCl Cloruro de sodio
FeCl3 Cloruro Férrico
CaBr2 Bromuro Calcico
LiF Fluoruro de litio
AlCl3 Cloruro de aluminio
CuBr bromuro cuproso
CaF2 fluoruro de calcio
Kl yoduro de potasio
Mns sulfuro de manganeso
KNO3 nitrato de potasio
SnSiO3 trioxosilicato (IV) de estaño o silicato de estaño
LiF fluoruro lítico
NiF2 fluoruro niqueloso
NiF3 fluoruro niquélico
TiF2 fluoruro hipotitanioso
NaClO oxoclorato (I) de sodio
K2SO4 tetraoxosulfato (VI) de potasio
CaF2 difluoruro de calcio fluoruro de calcio fluoruro de calcio
AlCl3 tricloruro de aluminio cloruro de aluminio cloruro de aluminio
CuBr2 dibromuro de cobre bromuro cúprico bromuro de cobre (II)
CuBr bromuro de cobre bromuro cuproso bromuro de cobre (I)
MnS sulfuro de manganeso sulfuro manganoso sulfuro de manganeso (II)
MnS2 disulfuro de manganeso sulfuro mangánico sulfuro de manganeso (IV)
CaTe telurio de calcio telurio de calcio telurio de calcio
KI yoduro de potasio yoduro potásico yoduro de potasio
FeCl2 dicloruro de hierro cloruro ferroso cloruro de hierro (II)
FeCl3 tricloruro de hierro cloruro férrico cloruro de hierro (III)
NiS sulfuro de níquel sulfuro niqueloso sulfuro de níquel (II)
K2S sulfuro de dipotasio sulfuro de potasio sulfuro de potasio
PtF2 difluoruro de platino fluoruro platinoso fluoruro de platino (II)
Li3N nitruro de trilitio nitruro de litio nitruro de litio (I)
Mg3N2 dinitruro de trimagnesio nitruro magnésico nitruro de magnesio (II)
No hay comentarios:
Publicar un comentario