ÁCIDOS OXÁCIDOS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Se llaman oxácidos u oxoácidos, y obedecen a una fórmula general: HaXbOc en la que X es normalmente un no metal, pero a veces también puede ser un metal de transición que se encuentra en un número de oxidación elevado, como Cr+6, Mn+6 o Mn+7. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Este es el único tipo de compuestos en el que permanece la nomenclatura antigua. La IUPAC propone una nueva nomenclatura, que aún está poco extendida dado que cuesta bastante deshabituarse de decir, por ejemplo ácido sulfúrico, que es un compuesto de uso frecuente, a decir dihidroxidodioxidoazufre o dihidrogeno(tetraoxidosulfato), como propone la IUPAC. Ella misma admite como válida la nomenclatura tradicional en este tipo de compuestos. Nomenclatura tradicional aceptada. Para aprender a formular este tipo de compuestos hay que conocer los números de oxidación con los que los no metales pueden actuar. Estos son los siguientes
Si nos dan la fórmula del ácido tenemos que deducir el número de oxidación del elemento central X (+n), será igual al doble de oxígenos que tenga menos los hidrógenos. Si del elemento central tenemos varios átomos el resultado lo dividimos por ese número.
Cuando un elemento presenta más de un número de oxidación posible se emplean unos prefijos y unos sufijos concretos. Como el número más elevado de posibles números de oxidación para un elemento (en los casos que vamos a estudiar) es cuatro nos referiremos a estos casos. Para el número de oxidación MÁS ALTO se antepone al nombre del elemento central el prefijo PER- (del griego hyper, superior) y el sufijo -ICO. Para el número de oxidación ALTO se añade al nombre del elemento central el sufijo -ICO. Para el número de oxidación BAJO se añade al nombre del elemento central el sufijo -OSO. Para el número de oxidación MÁS BAJO se añade el prefijo HIPO- (del griego hypo, inferior) y detrás del nombre el sufijo -OSO.
Otros prefijos que debemos conocer son los prefijos meta- y orto- : de algunos ácidos se conocen dos formas, que se diferencian en el número de hidrógenos y oxígenos, de forma que parecen diferenciarse en un determinado número de moléculas de agua H2O. Por ejemplo, tenemos dos ácidos peryódicos: el HIO4 y el H5IO6, éste es como si tuviera 2 moléculas de agua más que el primero. El prefijo meta- se utiliza para indicar el ácido que tiene menor contenido en agua y el prefijo orto- se utiliza para indicar el ácido que tiene mayor contenido en agua. HIO4 es el ácido metaperyódico y H5IO6 es el ácido ortoperyódico. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
En la fórmula: Deducimos el número de oxidación del elemento central, como vimos es el doble de los oxígenos menos los hidrógenos, y según sea (más alto, alto, bajo, o más bajo) ponemos los prefijos y sufijos que correspondan (per- -ico, -ico, -oso, o hipo- -oso).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
En el nombre: A partir de los prefijos y sufijos deducimos el número de oxidación del elemento central. El hidrógeno tiene número de oxidación +1 y el oxígeno –2. Buscamos luego unos coeficientes que hagan que la carga aportada por los oxígenos sea igual y de signo contrario a la aportada por los hidrógenos y el elemento central.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Observa el siguiente vídeo donde se explican algunos ejemplos: Los oxácidos más comunes son: HALÓGENOS: números de oxidación: +1, +3, +5, +7. Dan oxácidos el Cl, Br, I pero no el F.
El oxácido correspondiente al número de oxidación +3 para el yodo (I) no tiene existencia real y tampoco se conoce ningún derivado suyo. CALCÓGENOS: números de oxidación: +4, +6. Estudiaremos los oxácidos del S, Se, Te.
NITROGENOIDEOS: números de oxidación: +3, +5. Estudiaremos los oxácidos del N, P, As.
Debemos recordar que los oxácidos de P e As son distintos a los de N ya que el número de H que llevan es 3. Estos ácidos con dos hidrógenos más, se denominan ácidos orto-, aunque no es muy utilizado dicho prefijo, pues los ácidos meta no se conocen.
CARBONO Y SILICIO: número de oxidación: +4.
CROMO Y MANGANESO: No sólo forman ácidos los no metales sino también muchos de los metales de transición, por ejemplo el Cr y Mn.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Recuerda que el objetivo de la nomenclatura sistemática es que el nombre refleje la composición del compuesto, y hoy en día se pide más, que incluso refleje la composición estructural del compuesto. Así para los oxácidos la IUPAC propone en las normas 2005 dos nomenclaturas, aparte de admitir como válida la tradicional que has estudiado arriba, una es la nomenclatura de adición y otra es la nomenclatura de hidrógeno. La nomenclatura de adición se basa en la estructura de los ácidos, nombrando de diferente forma los oxígenos que están unidos a los hidrógenos ácidos (hidroxido), los oxígenos unidos únicamente al elemento central (oxido). Cada uno de estos nombres se acompaña de los prefijos pertinentes: di-, tri-, tetra-, etc. y se nombran por orden alfabético seguidos del nombre del átomo central Prefijo-hidroxido-prefijo-oxido-ELEMENTO CENTRAL La nomenclatura de hidrógeno se basa en nombrar con un prefijo: di-, tri-, tetra-, etc. los hidrógenos del ácido (se usa la palabra "hidrogeno" sin tilde pero enfatizada en la sílaba "dro") seguido del nombre de adición del anión terminado en "-ato" entre paréntesis y unido sin espacios a la palabra "hidrogeno". Prefijo-hidrógeno(prefijo-oxido-ELEMENTO CENTRAL-ato)
TAREA ESCRIB IR DIEZ ÁCIDOS OXÁCIDOS CON SU REACCIÓN Y NOMBRE | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
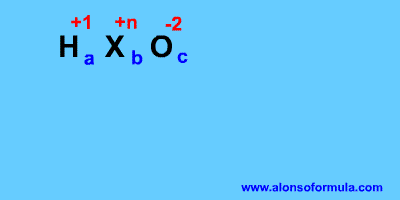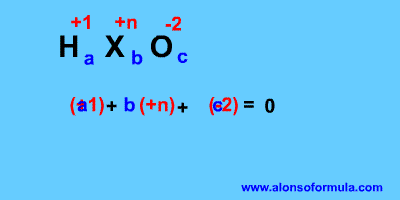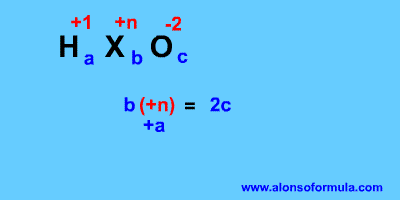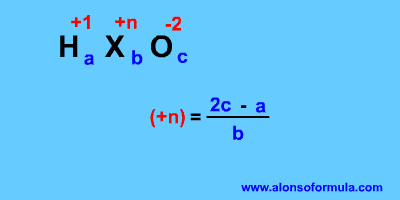


No hay comentarios:
Publicar un comentario