Molaridad, molalidad, normalidad
La Concentración se define como la Cantidad o Proporción de una determinada sustancia, presente en una Solución. La Solución es una mezcla Homogénea (de una sola fase visible) que puede ser sólida, liquida o gaseosa, por lo que la Concentración se puede expresar en diferentes maneras.
Es preciso definir que una Solución contiene dos componentes principales: Soluto y Disolvente, y generalmente, la Concentración se enfoca en expresar cuánto Soluto hay mezclado en Toda la Solución. Sin embargo, la Concentración puede expresar la cantidad o proporción de cualquiera de ellos.
Expresión de la Concentración
En Química, la Cantidad de sustancia presente en una solución se puede expresar en varias maneras diferentes: Molaridad, Molalidad, Normalidad, Porcentaje en peso, Porcentaje en Volumen.
De estas cinco unidades, todas se pueden aplicar tanto a soluciones sólidas, como a liquidas y gaseosas. Pero la Molalidad, por ejemplo, es la que se usa más para Soluciones sólidas.
Ejemplos de Molaridad
La Molaridad indica cuántos moles de sustancia hay en cada Litro de Solución completa. Es la unidad más utilizada en química para soluciones liquidas, en el momento de hacer Análisis Volumétricos. Se indica con la letra “M”.
Conociendo los gramos de Soluto, éstos se dividen entre el Peso Molecular del Soluto. Así, se obtienen los Moles de Soluto presentes en la Solución.
Acto seguido, los Moles de Soluto son divididos por los Litros de Solución, y así se obtienen las unidades de la Molaridad: Moles de Soluto/Litro de Disolución
1.- Para una disolución de 0.5 litros de Hidróxido de Magnesio [Mg(OH)2], y si el Peso Molecular del Hidróxido de Magnesio es de 58 g/mol. Se tienen 36 gramos de éste.
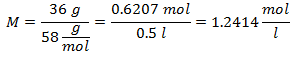
2.- Para una disolución de 1 litro de Hidróxido de Calcio [Ca(OH)2], y si el Peso Molecular del Hidróxido de Calcio es de 74 g/mol. Se tienen 42 gramos de éste.
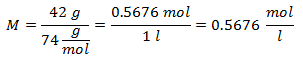
3.- Para una disolución de 3 litros de Cloruro de Sodio (NaCl), y si el Peso Molecular del Cloruro de Sodio es de 58 g/mol. Se tienen 28 gramos de éste.
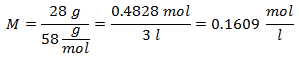
4.- Para una disolución de 5 litros de Cloruro de Calcio (CaCl2), y si el Peso Molecular del Cloruro de Calcio es de 110 g/mol. Se tienen 13 gramos de éste.
![]()
5.- Para una disolución de 10 litros de Sulfato de Sodio (Na2SO4), y si el Peso Molecular del Sulfato de Sodio es de 142 g/mol. Se tienen 96 gramos de éste.
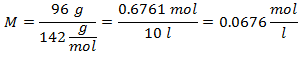
Ejemplos de Molalidad
La Molalidad indica cuántos moles de Soluto hay por cada 1000 gramos de Disolvente en la Solución. Es la unidad más utilizada en química para soluciones sólidas. Se indica con la letra “m”.
Conociendo los gramos de Soluto, éstos se dividen entre el Peso Molecular del Soluto. Así, se obtienen los Moles de Soluto presentes en la Solución
Acto seguido, los Moles de Soluto se ajustan para cada 1000 gramos de Solución, que se establecen como base de cálculo, y así se obtienen las unidades de la molalidad: Moles de Soluto/1000g de Disolvente.
1.- Para una disolución con 1000g de Mineral disolvente y 36 gramos de Hidróxido de Magnesio [Mg(OH)2], y si el Peso Molecular del Hidróxido de Magnesio es de 58 g/mol.
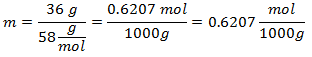
2.- Para una disolución de 2000g de Mineral disolvente y 42 gramos de Hidróxido de Calcio [Ca(OH)2], y si el Peso Molecular del Hidróxido de Calcio es de 74 g/mol.
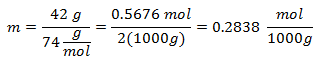
3.- Para una disolución de 3000g de Mineral disolvente y 28 gramos de Cloruro de Sodio (NaCl), y si el Peso Molecular del Cloruro de Sodio es de 58 g/mol.
![]()
4.- Para una disolución de 5000g de Mineral disolvente y 13 gramos de Cloruro de Calcio (CaCl2), y si el Peso Molecular del Cloruro de Calcio es de 110 g/mol.
![]()
5.- Para una disolución de 10,000g de Mineral disolvente y 96 gramos de Sulfato de Sodio (Na2SO4), y si el Peso Molecular del Sulfato de Sodio es de 142 g/mol.
![]()
Se manejan las cantidades de Disolvente como múltiplos de 1000g, para dejar los 1000 gramos como referencia y no incluirlos afectando el cálculo.
Ejemplos de Normalidad
La Normalidad indica cuántos Equivalentes de sustancia hay en cada Litro de Solución completa. La Normalidad es la otra unidad más utilizada en química para soluciones liquidas, en el momento de hacer Análisis Volumétricos. Se indica con la letra “N”.
Un Equivalente es una unidad que resulta de dividir los gramos del Soluto (g) entre el Peso Equivalente (Peq) del mismo. El Peso Equivalente (Peq) resulta de dividir el Peso Molecular (PM) entre la Valencia activa (*), que es más fácil de observar en Ácidos y Bases. Por ejemplo, la Valencia activa del Ácido Clorhídrico (HCl) es 1; la Valencia activa del Hidróxido de Calcio [Ca(OH)2] es 2, por los iones Hidrógeno (H+) e Hidroxilo (OH-) que cada uno presenta
Acto seguido, los Equivalentes de Soluto son divididos por los Litros de Solución, y así se obtienen las unidades de la Normalidad: Equivalentes de Soluto/Litro de Disolución.
1.- Para una disolución de 0.5 litros de Hidróxido de Magnesio [Mg(OH)2], y si el Peso Molecular del Hidróxido de Magnesio es de 58 g/mol. Se tienen 36 gramos de éste.
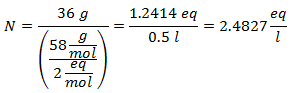
2.- Para una disolución de 1 litro de Hidróxido de Calcio [Ca(OH)2], y si el Peso Molecular del Hidróxido de Calcio es de 74 g/mol. Se tienen 42 gramos de éste.
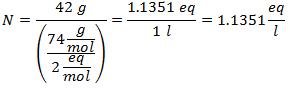
3.- Para una disolución de 3 litros de Cloruro de Sodio (NaCl), y si el Peso Molecular del Cloruro de Sodio es de 58 g/mol. Se tienen 28 gramos de éste.
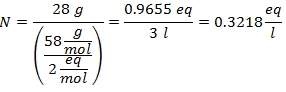
4.- Para una disolución de 5 litros de Cloruro de Calcio (CaCl2), y si el Peso Molecular del Cloruro de Calcio es de 110 g/mol. Se tienen 13 gramos de éste.
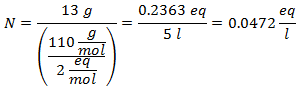
5.- Para una disolución de 10 litros de Sulfato de Sodio (Na2SO4), y si el Peso Molecular del Sulfato de Sodio es de 142 g/mol. Se tienen 96 gramos de éste.
No hay comentarios:
Publicar un comentario