Alqueno
Los alquenos son hidrocarburos insaturados que tienen doble enlace carbono-carbono en su molécula. Se puede decir que un alqueno es un alcano que ha perdido dos átomos de hidrógeno produciendo como resultado un enlace doble entre dos carbonos. Los alquenos cíclicos reciben el nombre de cicloalquenos.
Antiguamente se les denominaba como olefinas dadas las propiedades que presentaban sus representantes más simples, principalmente el eteno, para reaccionar con halógenos y producir óleos
Formulación y nomenclatura de alquenoS
La fórmula general de un alqueno de cadena abierta con un solo doble enlace es CnH2n. Por cada doble enlace adicional habrá dos átomos de hidrógeno menos de los indicados en esta fórmula.
Nombres tradicionales
Al igual que ocurre con otros compuestos orgánicos, algunos alquenos se conocen todavía por sus nombres no sistemáticos, en cuyo caso se sustituye la terminación -eno sistemática por -ileno, como es el caso del eteno que en ocasiones se llama etileno, o propeno por propileno.
Nomenclatura sistemática (IUPAC)
1. Nombrar al hidrocarburo principal: Se ha de encontrar la cadena carbonada más larga que contenga el enlace doble, no necesariamente la de mayor tamaño, colocando los localizadores que tengan el menor número en los enlaces dobles, numerando los átomos de carbono en la cadena comenzando en el extremo más cercano al enlace doble. NOTA: Si al enumerar de izquierda a derecha como de derecha a izquierda, los localizadores de las insaturaciones son iguales, se busca que los dobles enlaces tenga menor posición o localizador más bajo.
2. Si la cadena principal tiene sustituyentes iguales en el mismo átomo de carbono separando por comas los números localizadores que se repiten en el átomo, estos se separan por un guion de los prefijos: di, tri, tetra, etc. Respectivamente al número de veces que se repita el sustituyente.
3. Los sustituyentes se escriben de acuerdo al orden alfabético con su respectivo localizador.
4. Si en la cadena principal existen varios sustituyentes ramificados iguales se coloca el número localizador en la cadena principal separando por un guion, y se escribe el prefijo correspondiente al número de veces que se repita con los prefijos: bis, tris, tetraquis, pentaquis, etc. Seguido de un paréntesis dentro del cual se nombra al sustituyente complejo con la terminación -IL.
5. Realizado todo lo anterior con relación a los sustituyentes, se coloca el número de localizador del doble enlace en la cadena principal separada de un guion, seguido del nombre de acuerdo al número de átomos de carbono reemplazando la terminación -ano por el sufijo -eno.
6. Si se presentan más de un enlace doble, se nombra indicando la posición de cada uno de los dobles enlaces con su respectivo número localizador, se escribe la raíz del nombre del alqueno del cual proviene, seguido de un prefijo de cantidad: di, tri, tetra, etc. y utilizando el sufijo -eno. Ej:-dieno, -trieno y así sucesivamente.
| Fórmula | Recomendaciones IUPAC-1979 | Recomendaciones IUPAC-199312 |
|---|---|---|
| localizador - prefijo de número átomos C (acabado en -eno) | prefijo de número átomos C - localizador -eno | |
| CH3-CH2-CH=CH2 | 1-buteno | but-1-eno |
| Fórmula | Recomendaciones IUPAC-1979 | Recomendaciones IUPAC-1993 |
|---|---|---|
| localizador - prefijo de número átomos C (acabado en -eno) | prefijo de número átomos C - localizador -eno | |
| 1-penteno | pent-1-eno | |
| 1-ciclohexeno | ciclohex-1-eno | |
| 2-buteno | but-2-eno | |
| 3-hepteno | hept-3-eno | |
| 1,3-butadieno | buta-1,3-dieno | |
| 1,3,6-octatrieno | octa-1,3,6-trieno | |
| 1,3,5,7-ciclooctatetraeno | cicloocta-1,3,5,7-tetraeno | |
| 3-metil-1-buteno | 3-metil -but-1-eno |
Estructura electrónica del enlace doble C=C
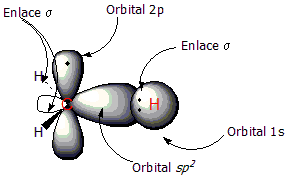
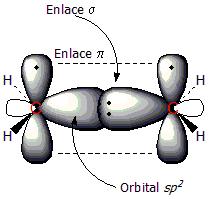
Utilizaremos el eteno como ejemplo de compuesto con doble enlace C=C. El doble enlace tiene dos componentes: el enlace tipo σ y el enlace tipo π. Los dos átomos de carbono que comparten el enlace tienen una hibridación sp2, hibridación resultante de la mezcla de un orbital 2s y dos orbitales 2p, lo cual conduce a la formación de tres orbitales sp2 de geometría trigonal plana. Al combinarse estos orbitales sp2 los electrones compartidos forman un enlace σ, situado entre ambos carbonos.
En la primera figura puede observarse el radical metilo, con un orbital sp2 que enlaza a un átomo de hidrógeno al carbono. En la segunda figura se aprecia la formación del enlace π (línea de puntos); que se forma mediante el solapamiento de los dos orbitales 2p perpendiculares al plano de la molécula. En este tipo de enlace los electrones están deslocalizados alrededor de los carbonos, por encima y por debajo del plano molecular.


No hay comentarios:
Publicar un comentario