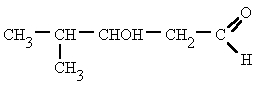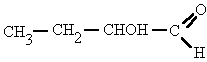jueves, 31 de enero de 2019
Biotecnología ( 3 de BGU) Cite cinco ejemplos de biotecnología en alimentos
Definiendo la biotecnología
en términos generales, la biotecnología se puede definir como un conjunto de técnicas en que se utilizan organismos vivos, partes de ellos o moléculas derivadas de organismos vivos para fabricar o modificar productos. además, comprende aquellas técnicas de modificación genética de variedades de plantas, animales o microorganismos para su utilización con un propósito específico.
las principales disciplinas que se aplican en el ámbito de la biotecnología son la microbiología, la bioquímica y la ingeniería genética.
la biotecnología posee la capacidad de cambiar la comunidad industrial del siglo xxi debido a su potencial para producir cantidades prácticamente ilimitadas de:
· sustancias de las que nunca se había dispuesto antes
· productos que se obtienen normalmente en cantidades pequeñas
· productos con costo de producción mucho menor que el de los fabricados por medios convencionales
· productos que ofrecen mayor seguridad que los hasta ahora disponibles
· productos obtenidos a partir de nuevas materias primas más abundantes y baratas
Objetivos de la biotecnología de alimentos
el objetivo fundamental de la biotecnología de alimentos es la investigación acerca de los procesos de elaboración de productos alimenticios mediante la utilización de organismos vivos o procesos biológicos o enzimáticos, así como la obtención de alimentos genéticamente modificados mediante técnicas biotecnológicas.
Areas de aplicación
los aportes de la biotecnología para apoyar los procesos productivos de la industria alimentaria y agroalimentaria se enfocan a dos grandes líneas prioritarias de investigación:
1. tecnología enzimática y biocatálisis
2. alimentos genéticamente modificados
1. tecnología enzimática y biocatálisis
el área de tecnología enzimática y biocatálisis incluye el extenso campo de las fermentaciones en procesamiento de alimentos, así como la mejora genética de microorganismos de aplicación en tecnología de alimentos y la producción de proteínas y enzimas de uso alimentario.
Fermentaciones
la fermentación es la transformación de una sustancia orgánica (generalmente un carbohidrato) en otra utilizable, producida mediante un proceso metabólico por microorganismos o por enzimas que provocan reacciones de oxidación-reducción, de las cuales el organismo productor deriva la energía suficiente para su metabolismo. las fermentaciones pueden ser anaeróbicas, si se producen fuera del contacto con el aire, o aeróbicas, que sólo tienen lugar en presencia de oxígeno.
las fermentaciones más comunes en la industria de alimentos son la del azúcar, con formación de alcohol etílico, en la elaboración de vino, cerveza, sidra; la del alcohol, con formación de ácido acético, en la elaboración del vinagre; y la fermentación láctica, en la elaboración de quesos y yogures.
actualmente en la industria fermentativa se utilizan tanques de fermentación en los que ésta se realiza en condiciones controladas de temperatura y presión y que permiten regular constantemente la entrada y salida de productos.
los diversos tipos de fermentaciones en la industria de alimentos se pueden clasificar de la siguiente manera:
- fermentaciones no alcohólicas
· panadería (fermentación por levaduras de panadería)
· vegetales fermentados (encurtidos en general)
· ensilado (fermentación de forraje)
- fermentaciones alcohólicas
Hidruros metálicos ( 1 de BGU9 Realizar ejercicio del final del texto
Hidruros metálicos
Hidrógeno +
Metal
La fórmula general es MHm
(el metal siempre delante del hidrógeno) donde m es la valencia del metal. La
valencia del Hidrógeno es 1.
|
Nomenclatura Funcional:
| - oso (valencia menor) | ||
hidruro
|
(nombre del metal terminado en)
|
|
| - ico (valencia mayor) | ||
(nombre genérico)
|
Nomenclatura de Stock:
| hidruro de | (nombre del metal sin variar) | ( ) |
| (nombre genérico) | (valencia del metal en números romanos siempre que tenga más de una) |
Nomenclatura
Estequiométrica:
| (prefijo griego) | Hidruro de | nombre del metal sin variar |
Ejemplos:
| Nomenclatura | |||
| Fórmula | Nombre 1 | Nombre 2 | |
| NaH | |||
| KH | |||
| CaH2 | |||
| AlH3 | |||
| FeH2 | |||
| HgH2 | |||
| AgH | |||
| CrH2 | |||
| CrH3 | |||
Balanceo ( 2 de BGU) Realizar el ejercicio de la pag. 81 numero 17 literal a el segundo.
Balanceo de ecuaciones químicas
Ejemplo 4.2.
Reacción de descomposición del clorato de potasio
2 KClO3 (s) → 2 KCl(s) + 3 O2 (g)
suponiendo que reaccionan 2 mol de KClO3, se producen 2 mol de KCl y 3 mol de O2. Si se hace un balance elemento a elemento, se observa que:2 mol de K en los reactivos ≡ 2 mol de K en los productos
2 mol de Cl en los reactivos ≡ 2 mol de Cl en los productos
6 mol de O en los reactivos ≡ 6 mol de O en los productos
Ejemplo 4.3.
Como lo indica la figura, por 1 mol de CH4 (g) que reacciona, se requieren 2 mol de O2 (g) para formar 1 mol de CO2 (g) y 2 mol de H2O (g).
Balanceo de ecuaciones químicas por simple inspección
Ejemplo 4.4.
Balancear la siguiente ecuación:
H2SO4 + Al(OH)3 → Al2(SO4)3 + H2O
Balanceo de metales (Al)
H2SO4 + 2 Al(OH)3 → Al2(SO4)3 + H2O
Balanceo de no metales (S)
3 H2SO4 + 2 Al(OH)3 → Al2(SO4)3 + H2O
Balanceo de H y de O
3 H2SO4 + 2 Al(OH)3 → Al2(SO4)3 + 6 H2O
Balanceo de ecuaciones químicas por el método redox
Primero se balanceará una ecuación química molecular (no participan especies iónicas).Ejemplo 4.5.
Balancear por el método redox:
K2Cr2O7 + FeSO4 + H2SO4 → Fe2(SO4)3 + CrSO4 + K2SO4
Determinar los números de oxidación de los elementos involucrados en
la reacción y tener en cuenta sólo aquellos cuyo número de oxidación
cambia.
El Cr se reduce porque su número de oxidación disminuye de +6 a +2.
Gana 4 e-/ átomo, es decir 8 e-/molécula (nótese el subíndice 2)
El Fe se oxida porque su número de oxidación aumenta de +2 a +3.
Pierde 1 e-/ átomo, es decir 1 e-/molécula

Continuar el balance por tanteo. Tener en cuenta el siguiente orden: (1) Elementos que varían su estado de oxidación, (2) Metales, (3) No metales, (4) Hidrógeno y oxígeno.
(1) K2Cr2O7 + 8 FeSO4 + H2SO4 → 4 Fe2(SO4)3 + 2 CrSO4 + K2SO4
(2) K2Cr2O7 + 8 FeSO4 + H2SO4 → 4 Fe2(SO4)3 + 2 CrSO4 + K2SO4
(3) K2Cr2O7 + 8 FeSO4 + H2SO4 → 4 Fe2(SO4)3 + 2 CrSO4 + K2SO4
(4) K2Cr2O7 + 8 FeSO4 + 7 H2SO4 → 4 Fe2(SO4)3 + 2 CrSO4 + 7 K2SO4
Ahora se balancerá una reacción química iónica (en ella participan especies iónicas)
Ejemplo 4.6.
Balancear por el método redox, en medio ácido:
HPO32- + BrO3- → BrO3- + H2PO4-
Se sigue el mismo procedimiento anterior excepto cuando se balancea el hidrógeno y el oxígeno

Ejemplo 4.7.
Balancear por el método redox, en medio básico:
P4 + ClO- → H2PO4- + Cl-
Se sigue el mismo procedimiento del ejemplo 4.5. excepto cuando se balancea el hidrógeno y el oxígeno

I2 + KNO3 → I- + KIO3 + NO3-
Se sigue el mismo procedimiento del ejemplo 4.5. excepto cuando se
balancea el hidrógeno y el oxígeno. Cuando hay auto óxido-reducción (una
misma sustancia se oxida y se reduce) se emplea el truco de escribirla
dos veces.
ALCOHOLES ( 3 de BGU) Realizar cinco dioles y cinco trioles con sus nombres
ALCOHOLES
Alcoholes son aquellos compuestos orgánicos en cuya estructura se encuentra el grupo hidroxilo (-OH), unido a un carbono que solo se acopla a otro carbono o a hidrógenos.
Pueden ser alifáticos (R-OH) o aromáticos (Ar-OH) estos últimos se conocen como fenoles.
Son un grupos de compuestos muy importantes, no solo por su utilidad industrial, de laboratorio, teórica, o comercial, si no también, porque se encuentran muy extensamente en la vida natural.
Cuando en la molécula del alcohol hay mas de un grupo hidroxilo se les llama polioles o alcoholes polihídricos. Si son dos grupos hidroxilos se llaman glicoles, tres, gliceroles, cuatro tetrioles y así sucesivamente.
NomenclaturaEs común que los alcoholes se nombren usando la palabra alcohol como nombre, y con el "apellido" del grupo correspondiente a los alcanos básicos que le dan lugar, esta nomenclatura se ilustra a continuación.

PROPIEDADES FISICAS
Propiedades Físicas:
El grupo –OH es muy polar y, lo que es más importante, es capaz de establecer puentes de hidrógeno: con sus moléculas compañeras o con otras moléculas neutras.
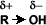
Solubilidad: Puentes de hidrógeno: La formación de puentes de hidrógeno permite la asociación entre las moléculas de alcohol. Los puentes de hidrógeno se forman cuando los oxígenos unidos al hidrógeno en los alcoholes forman uniones entre sus moléculas y las del agua. Esto explica la solubilidad del metanol, etanol, 1-propanol, 2-propanol y 2 metil-2-propanol.
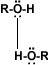
alcohol-alcohol
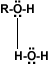
alcohol-agua
A partir de 4 carbonos en la cadena de un alcohol, su solubilidad disminuye rápidamente en agua, porque el grupo hidroxilo (–OH), polar, constituye una parte relativamente pequeña en comparación con la porción hidrocarburo. A partir del hexanol son solubles solamente en solventes orgánicos.
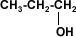
1 propanol
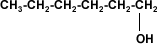
Hexanol
2-metil-2-propanol
Existen alcoholes de cuatro átomos de carbono que son solubles en agua, debido a la disposición espacial de la molécula. Se trata de moléculas simétricas
Existen alcoholes con múltiples moléculas de OH (polihidroxilados) que poseen mayor superficie para formar puentes de hidrógeno, lo que permiten que sean bastante solubles en agua.
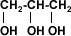
1,2,3 propanotriol (glicerina)
CLASIFICACIONLos alcoholes son el grupo de compuestos químicos que resultan de la sustitución de uno o varios átomos de hidrógeno (H) por grupos hidroxilo (-OH) en los hidrocarburos saturados o no saturados.
Alcoholes primarios, secundarios y terciarios
Un alcohol es primario, si el átomo de hidrogeno (H) sustituido por el grupo oxidrilo (-OH) pertenece a un carbón (C) primario:
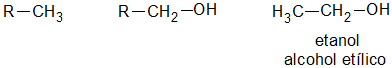
es secundario, si el átomo de hidrogeno (H) sustituido por el grupo oxidrilo (-OH) pertenece a un carbón (C) secundario:
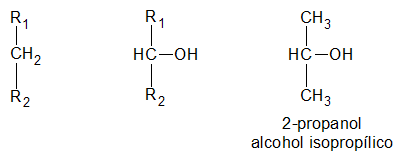
y finalmente, es terciario, si el átomo de hidrogeno (H) sustituido por el grupo oxidrilo (-OH) pertenece a un carbón (C) terciario:
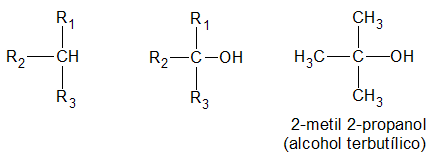
La función alcohol puede repetirse en la misma molécula, resultando monoles, o alcoholes monovalentes; dioles, o alcoholes bivalentes; trioles, o alcoholes trivalentes, etc.
ETANOL
El compuesto químico etanol, conocido como alcohol etílico, es un alcohol que se presenta en condiciones normales de presión y temperatura como un líquido incoloro e inflamable con un punto de ebullición de 78 °C.
Mezclable con agua en cualquier proporción; a la concentración de 95% en peso se forma una mezcla azeotrópica.
Su fórmula química es CH3-CH2-OH (C2H6O), principal producto de las bebidas alcohólicas como el vino (alrededor de un 13%), la cerveza (5%) o licores (hasta un 50%).
Además de usarse con fines culinarios (bebida alcohólica), el etanol se utiliza ampliamente en muchos sectores industriales y en el sector farmacéutico, como excipiente de algunos medicamentos y cosméticos (es el caso del alcohol antiséptico 70º GL y en la elaboración de ambientadores y perfumes).
Es un buen disolvente, y puede utilizarse como anticongelante. También es un desinfectante. Su mayor potencial bactericida se obtiene a una concentración de aproximadamente el 70%.
Industria química
La industria química lo utiliza como compuesto de partida en la síntesis de diversos productos, como el acetato de etilo (un disolvente para pegamentos, pinturas, etc.), el éter dietílico, etc.
También se aprovechan sus propiedades desinfectantes.
CombustibleEtanol (combustible)
Se emplea como combustible industrial y doméstico. En el uso doméstico se emplea el alcohol de quemar. Este además contiene compuestos como la pirovidos exclusivamente a alcohol. Esta última aplicación se extiende también cada vez más en otros países para cumplir con el protocolo de Kyoto. Estudios del Departamento de Energía de EUA dicen que el uso en automóviles reduce la producción de gases de invernadero en un 85%. En países como México existe la política del ejecutivo federal de apoyar los proyectos para la producción integral de etanol y reducir la importación de gasolinas que ya alcanza el 60%.
METANOL
El compuesto químico metanol, también conocido como alcohol metílico o alcohol de madera, es el alcohol más sencillo. A temperatura ambiente se presenta como un líquido ligero (de baja densidad), incoloro, inflamable y tóxico que se emplea como anticongelante, disolvente y combustible. Su fórmula química es CH3OH (CH4O).Mezclable con agua en cualquier proporción; a la concentración de 95% en peso se forma una mezcla azeotrópica.
Su fórmula química es CH3-CH2-OH (C2H6O), principal producto de las bebidas alcohólicas como el vino (alrededor de un 13%), la cerveza (5%) o licores (hasta un 50%).
Además de usarse con fines culinarios (bebida alcohólica), el etanol se utiliza ampliamente en muchos sectores industriales y en el sector farmacéutico, como excipiente de algunos medicamentos y cosméticos (es el caso del alcohol antiséptico 70º GL y en la elaboración de ambientadores y perfumes).
Es un buen disolvente, y puede utilizarse como anticongelante. También es un desinfectante. Su mayor potencial bactericida se obtiene a una concentración de aproximadamente el 70%.
Industria química
La industria química lo utiliza como compuesto de partida en la síntesis de diversos productos, como el acetato de etilo (un disolvente para pegamentos, pinturas, etc.), el éter dietílico, etc.
También se aprovechan sus propiedades desinfectantes.
CombustibleEtanol (combustible)
Se emplea como combustible industrial y doméstico. En el uso doméstico se emplea el alcohol de quemar. Este además contiene compuestos como la pirovidos exclusivamente a alcohol. Esta última aplicación se extiende también cada vez más en otros países para cumplir con el protocolo de Kyoto. Estudios del Departamento de Energía de EUA dicen que el uso en automóviles reduce la producción de gases de invernadero en un 85%. En países como México existe la política del ejecutivo federal de apoyar los proyectos para la producción integral de etanol y reducir la importación de gasolinas que ya alcanza el 60%.
METANOL
El metanol tiene varios usos. Es un disolvente industrial y se emplea como materia prima en la fabricación de formaldehído. El metanol también se emplea como anticongelante en vehículos, combustible de bombonas de camping-gas, disolvente de tintas, tintes, resinas, adhesivos ,biocombustibles y aspartamo. El metanol puede ser también añadido al etanol para hacer que éste no sea apto para el consumo humano (el metanol es altamente tóxico) y para vehículos de modelismo con motores de explosión.
Enlaces químicos ( 1 de BGU) Realizar un resumen en el cuaderno de cada uno de los tipos de enlaces
Principales tipos de enlaces químicos entre átomos
A continuación puedes ver cuáles son los tres principales tipos de enlace químico a través del cual los diferentes átomos se unen para formar las distintas moléculas. Una de las principales diferencias entre ellos son los tipos de átomos que se usen (metálicos y/o no metálicos, siendo los metálicos poco electronegativos y los no metálicos mucho).1. Enlace iónico
El iónico es uno de los tipos de enlace químico más conocidos, siendo el que se forma cuando se unen un metal y un no metal (es decir, un componente con poca electronegatividad con uno con mucha).El electrón más externo del elemento metálico se verá atraído por el núcleo del elemento no metálico, cediendo el segundo el electrón al primero. Se forman compuestos estables, cuya unión es electroquímica. En esta unión el elemento no metálico pasa a ser anión al quedar finalmente con carga negativa (tras recibir el electrón), mientras que los metales se vuelven cationes de carga positiva.
Un ejemplo típico de enlace iónico lo encontramos en la sal, o en compuestos cristalizados. Los materiales formados por este tipo de unión tienden a necesitar una gran cantidad de energía para fundirlos y suelen ser duros, si bien pueden comprimirse y quebrarse con facilidad. En general tienden a ser solubles y pueden disolverse con facilidad.
2. Enlaces covalentes
El enlace covalente es un tipo de enlace caracterizado porque los dos átomos a unirse poseen propiedades electronegativas semejantes o incluso idénticas. El enlace covalente supone que ambos átomos (o más, si la molécula la forman más de dos átomos) comparten entre sí los electrones, sin perder ni ganar en cantidad.Este tipo de enlaces es el que suele formar parte de la materia orgánica, como por ejemplo la que configura nuestro organismo, y son más estables que los iónicos. Su punto de fusión es más bajo, hasta el punto que muchos compuestos se encuentran en estado líquido, y no son por lo general conductores de la electricidad. Dentro de los enlaces covalentes podemos encontrar varios subtipos.
Enlace covalente no polar o puro
Se refiere a un tipo de enlace covalente en que se unen dos elementos con el mismo nivel de electronegatividad y cuya unión no provoca que una de las partes pierda o gane electrones, siendo los átomos del mismo elemento. Por ejemplo el hidrógeno, el oxígeno o el carbono son algunos elementos que pueden unirse a átomos de su mismo elemento para formar estructuras. No son solubles.Enlace covalente polar
En este tipo de enlace covalente, en realidad el más usual, los átomos que se unen son de distintos elementos. Ambos poseen una electronegatividad semejante aunque no idéntica, con lo que tienen diferentes cargas eléctricas. Tampoco en este caso se pierden electrones en ninguno de los átomos, sino que los comparten.Dentro de este subgrupo también encontramos los enlaces covalentes bipolares, en que existe un átomo dador que comparte los electrones y otro u otros receptores que se benefician de dicha incorporación.
Cosas tan básicas e imprescindibles para nosotros como el agua o la glucosa se forman a partir de este tipo de enlace.
3. Enlace metálico
En los enlaces metálicos se unen entre sí dos o más átomos de elementos metálicos. Dicha unión se debe no a la atracción entre ambos átomos entre sí, si no entre un catión y los electrones que han quedado libres y ajenos haciendo que sea tal cosa. Los diferentes átomos configuran una red en torno a estos electrones, con patrones que se van repitiendo. Estas estructuras tienden a aparecer como elementos sólidos y consistentes, deformables pero difíciles de romper.Asimismo, este tipo de enlace se vincula a la conductividad eléctrica propia de los metales, al ser sus electrones libres.
Enlaces químicos entre moléculas
Si bien los principales enlaces químicos son los anteriores, a nivel de molécula podemos encontrarnos otras modalidades. Algunos de los principales y más conocidos son los siguientes.4. Por fuerzas de Van der Waals
Este tipo de unión se da entre moléculas simétricas y actúan en función de la atracción o repulsión entre moléculas o a la interacción de iones con moléculas. Dentro de este tipo de uniones podemos encontrar la unión de dos dipolos permanentes, dos dipolos inducidos o entre dipolo permanente e inducido5. Enlace de hidrógeno o por puente de hidrógeno
Este tipo de enlace entre moléculas se da una interacción entre el hidrógeno y otro elemento de elevada polaridad. En estos enlaces el hidrógeno tiene carga positiva y se ve atraído por átomos electronegativos polares, generando una interacción o puente entre ambos. Dicha unión es considerablemente débil. Un ejemplo lo encontramos en las moléculas de agua.Referencias bibliográficas:
- Chamizo J. A. (2006). Los modelos de la química, Educación Química, 17, 476-482.
- García, A.; Garritz; A. y Chamizo, J.A.. (2009). Enlace Químico. Una aproximación constructivista a su enseñanza.
lunes, 21 de enero de 2019
Gametogénesis ( 10 de EGB) Realizar los dibujos en el cuaderno
Gametogénesis: ovogénesis y espermatogénesis
Gametogénesis es la formación de gametos por medio de la MEIOSIS a partir de células germinales. Mediante este proceso el material genético de cada célula se reduce a la mitad. Así, el número de cromosomas que existe en las células germinales se reduce de diploide (doble) a haploide (único).
Si el proceso tiene como resultado producir espermatozoides se le denomina espermatogénesis. Si el resultado son óvulos se denomina ovogénesis.
Gametogénesis es la formación de gametos por medio de la MEIOSIS a partir de células germinales. Mediante este proceso el material genético de cada célula se reduce a la mitad. Así, el número de cromosomas que existe en las células germinales se reduce de diploide (doble) a haploide (único).
Si el proceso tiene como resultado producir espermatozoides se le denomina espermatogénesis. Si el resultado son óvulos se denomina ovogénesis.
La espermatogénesis,
es la gametogénesis en el hombre: el mecanismo encargado de la
producción de espermatozoides. Este proceso se desarrolla en las
testículos, aunque la maduración final de los espermatozoides se produce
en el epidídimo. La espermatogénesis (transformación de espermatogonias
hasta espermatozoides) tiene una duración aproximada de 64 a 75 días y
consta de varias etapas.
Las
espermatogonias permanecen en mitosis durante 16 días, dando lugar a
los espermatocitos primarios. Estos invierten 24 días en completar la
primera meiosis y dar lugar a los espermatocitos secundarios que
tardarán horas en convertirse en espermátides. Las espermátides se
diferencian, empleando otros 24 días en este proceso.
Las
espermátidas se convierten en espermatozoides: se produce una reducción
del citoplasma, el núcleo se alarga y se sitúa en la cabeza del
espermatozoide, las mitocondrias se colocan en el cuello y los
centriolos originan un flagelo o cola. Antes de salir por el pene para
realizar la fecundación, pasan por el epidídimo del testículo, donde se
realiza la espermiohistogénesis y obtienen el acrosoma, una especie de
casco hecho de enzimas (vital para la fecundación) y una capa que lo
protege del pH de la vagina (glicolema), la cual desaparecerá antes de
llegar al óvulo para lograr entrar en él con la fuerza del acrosoma. El
proceso que incluye la serie de cambios que experimentan las
espermátides para su transformación en espermatozoide se denomina
espermiogénesis.
Cuando
termina todo el proceso, los espermatozoides presentan zonas bien
diferenciadas: la cabeza, el cuello y la cola. La cabeza, contiene los
cromosomas de la herencia y lleva en su parte anterior un pequeño
saliente o acrosoma, cuya misión es perforar las envolturas del óvulo.
En el cuello o segmento se localiza el centrosoma y las mitocondrias,
que garantizan el aporte energético. La cola o flagelo es el filamento
que se encarga de generar la movilidad que le permite al espermatozoide
"moverse" hasta el óvulo para poder fecundarlo.
Los
espermatozoides son células haploides, con la mitad de los cromosomas
que una célula somática, son móviles y muy diferenciadas. La reducción
en ellas se produce mediante una división celular, la meiosis, donde una
célula diploide (2n) experimentará dos divisiones celulares sucesivas
sin un paso de duplicación del ADN entre dichas divisiones, con la
capacidad de generar cuatro células haploides (n).
La ovogénesis es
la gametogénesis femenina, es decir, el desarrollo y diferenciación del
gameto femenino u óvulo mediante una división meiótica y se lleva a
cabo en los ovarios. Este proceso se produce a partir de una célula
diploide y se forman como productos una célula haploide funcional (el
óvulo) y tres células haploides no funcionales (los cuerpos polares).
Las
células del organismo poseen una dotación genética compuesta por 46
cromosomas. Las células germinales poseen sólo 23. Al unirse tras la
fecundación un ovocito con 23 cromosomas y un espermatozoide con 23
cromosomas darán lugar a un EMBRIÓN con células de 46 cromosomas.


Óxidos metálicos ( 1 de BGU) Colocar un nombre conocido de los ejercicios
Óxidos metálicos nomenclatura tradicional
Óxido + el metal acabado en ……..En caso de tener 2 valencias
Si actúa con la valencia mayor –ico y si actúa con la menor –oso
Si tiene una única valencia se puede hacer acabando en –ico o no poniendo ningún prefijo
Nombrar en nomenclatura tradicional los siguientes óxidos
K2O
CaO
NiO
Ni2O3
SnO
SnO2
Ejercicio resuelto 3
|
Fórmula
|
N.Sistemática
|
N.STOCK
|
N.Tradicional
|
|
Ag2O
|
|||
|
CoO
|
|||
|
Au2O3
|
|||
|
Cu2O
|
Ejercicio 3
|
Fórmula
|
N.Sistemática
|
N.STOCK
|
N.Tradicional
|
|
Na2O
|
|||
|
FeO
|
|||
|
Fe2O3
|
|||
|
Au2O
|
|||
|
Au2O3
|
|||
|
PbO
|
Rendimiento de la reacción ≦ rendimiento teórico ( 2 de BGU) Realizar dos ejercicios iguales con distintos datos
Rendimiento de la reacción ≦ rendimiento teórico
- Es posible que no todos los productos reaccionen
- Es posible que haya reacciones laterales que no lleven al producto deseado
- La recuperación del 100% de la muestra es prácticamente imposible
Una cantidad que relaciona el rendimiento de la reacción con el rendimiento teórico se le llama rendimiento porcentual o % de rendimiento y se define así:
% de rendimiento = (Rendimiento de la Reacción / Rendimineto Teórico) * 100
Ejemplo: La reacción de 6,8 g de H2S con exceso de SO2, según la siguiente reacción, produce 8,2 g de S. ¿Cual es el rendimiento?
(Pesos Atómicos: H = 1,008, S = 32,06, O = 16,00).
2 H2S + SO2 ---------> 3S + 2H2O
En esta reacción, 2 moles de H2S reaccionan para dar 3 moles de S.
1) Se usa la estequiometría para determinar la máxima cantidad de S que puede obtenerse a partir de 6,8 g de H2S.
(6,8/34) x (3/2) x 32 = 9,6 g2) Se divide la cantidad real de S obtenida por la máxima teórica, y se multiplica por 100.
(8,2/9,6) x 100 = 85,4%
Rendimiento con Reactivos Limitantes
Ejemplo:
La masa de SbCl3 que resulta de la reacción de 3,00 g de antimonio y 2,00 g de cloro es de 3,65 g. ¿Cuál es el rendimiento? (Pesos Atómicos: Sb = 121,8, Cl = 35,45)
Sb4 + 6 Cl2 --------> 4 SbCl3
En esta reacción, 1 mol de Sb4 y 6 moles de Cl2 reaccionan para dar 4 moles de SbCl3.
1) Calcular el número de moles que hay de cada reactivo: Peso Molecular del Sb4: 487,2
número de moles de Sb4 = 3/487,2 = 0,006156Peso Molecular del Cl2: 70,9
número de moles de Cl2 = 2/70,9 = 0,02822) Comparar con la relación de coeficientes en la ecuación ajustada. La relación es de 1 mol de Sb4 a 6 moles de Cl2. Usando la estequiometría:
0,00656/0,0282 = 1/4,3 > 1/6de modo que el reactivo limitante es el Cl2. Nosotros sólo tenemos 0,0282 moles de Cl2.
3) Usar la estequiometría para determinar la máxima cantidad de SbCl3 que puede obtenerse con 2,00 g de Cl2 (el reactivo limitante).
2g Cl2 * (1 mol de Cl2/70,9g. de Cl2) * (4 mol de SbCl3/6 mol de Cl2) * (228,18g de SbCl3/1 mol de SbCl3) =4,29g de SbCl34) Dividir la cantidad real de SbCl3 obtenida por la máxima teórica y multiplicar por 100.
(3,65/4,29) x 100 = 85,08%
Alimentos fabricados con bioingeniería ( 3 de BGU) Colocar cinco ventajes y cinco desventajas del tema
Alimentos fabricados con bioingeniería

La
bioingeniería ha presionado a los granjeros más allá de la práctica de
la antigüedad de la crianza selectiva, donde un animal o variedad de
planta se cruzaba con una relacionada para obtener características
deseadas y suprimir las que eran menos útiles. Ahora, los científicos
pueden manipular los genes y crear nuevas variedades de especies no
relacionadas. Los alimentos, ingredientes y aditivos producidos por la
bioingeniería deben cumplir con los mismos estándares de seguridad de la
FDA que los productos tradicionales. La extensión total de cultivos de
bioingeniería aún es pequeña, pero representa una práctica en
crecimiento.
Seguridad
Los productores de alimentos son responsables de asegurarse que los alimentos que se venden son seguros. El Departamento de Agricultura de EE.UU. tiene la autoridad para retirar carne, aves de corral y productos de huevos producidos en plantas inspeccionadas federalmente y la FDA tiene autoridad para retirar todos los demás alimentos del mercado si presentan un riesgo para la salud pública.Riesgo de reacciones alérgicas
Un área de interés relacionada con la transferencia de material genético es la posibilidad de que las proteínas introducidas de un alimento a otro pueden ocasionar reacciones alérgicas en las personas que son sensibles al primer alimento. Por ejemplo, un tomate cultivado para producir una proteína que normalmente se encuentra en el maní puede ocasionar síntomas potencialmente mortales si lo come alguien que es alérgico al maní. Por esta razón, la FDA requiere pruebas científicas claras de seguridad de los desarrolladores que trabajan con alimentos a los que la gente es alérgica comúnmente, como la leche, los huevos, el trigo, el pescado, las nueces de árbol (por ejemplo, nogal, pecanas) y las leguminosas (por ejemplo, frijoles, maní). Es imposible predecir las reacciones alérgicas a las proteínas derivadas de las plantas u otras fuentes si no son causas reconocidas de alergia. No obstante, los científicos pueden probar una proteína creada por bioingeniería para ver si su estructura se asemeja a la de un alérgeno conocido. Si lo hace, más pruebas mostrarán si es probable una reacción alérgica cruzada.ALCOHOLES (3 DE BGU) Realizar diez alcoholes con radicales
Su estructura es similar a la de los
hidrocarburos, en los que se sustituye uno o más átomos de hidrógeno por
grupos "hidroxilo", -OH.
|
||||||||||||||
|
||||||||||||||
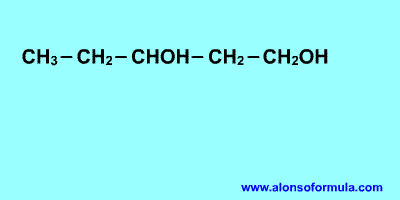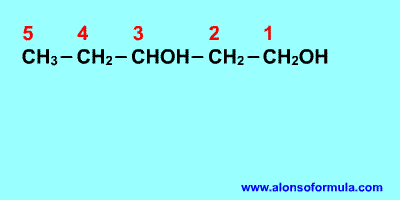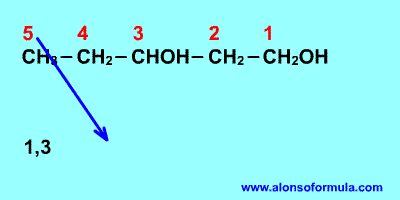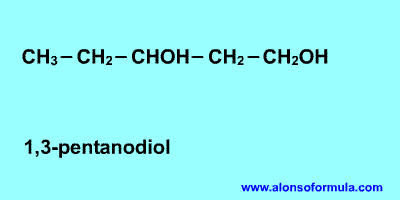
Sitúa los localizadores a partir del extremo que
tenga más cerca un grupo alcohol. Escribe los localizadores de los grupos OH seguidos
del nombre del hidrocarburo terminado en -ol, -diol, -triol, etc. según corresponda.
|
||||||||||||||
Sobre el esqueleto de átomos de carbono
sitúa los grupos OH y completa con los hidrógenos.
|
||||||||||||||
|
||||||||||||||