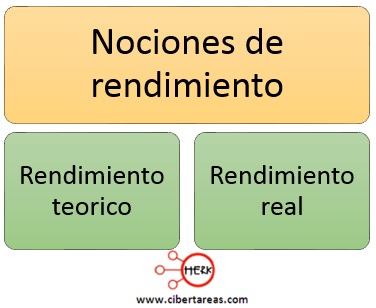
Rendimiento teórico, rendimiento real y porcentaje de rendimiento de una reacción
Se puede pensar que una
reacción química progresa hasta que se agota totalmente el reactivo
limitante, sin embargo en la realidad esto no sucede siempre ni en todos
los casos, por múltiples razones
Unas de las razones son:
-Existe la posibilidad de que no toda la materia prima reaccione
-Es posible que existan reacciones
laterales que no lleven al producto deseado o que no pueda recuperarse
totalmente el producto formado, lo cual ocasiona una merma en la
producción
Rendimiento teórico
-Cantidad de producto que debiera formarse si todo el reactivo limitante se consumiera en la reacción
Rendimiento real
-Cantidad de producto efectivamente formado en una reacción
Al analizar estos rendimientos, conduce a
una desigualdad, puesto que en la práctica, el rendimiento real es
igual o menor al rendimiento teórico

Cabe mencionar que los investigadores
trabajan frecuentemente modificando todas las variables de temperatura,
presión, concentración, catalizadores, etc., para llevar a los procesos
del rendimiento real hasta el rendimiento teórico en la medida de lo
posible
Ejemplo:
Problemática
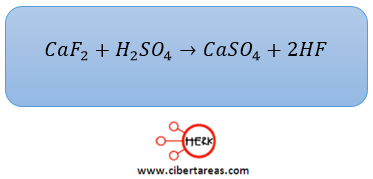
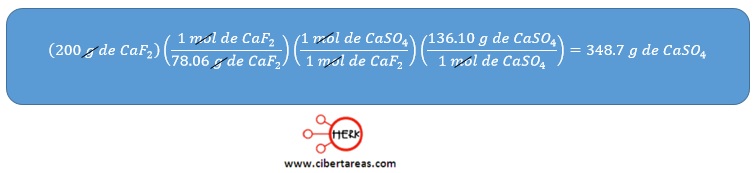
-Se preparó sulfato de calcio al hacer reaccionar 200 g de fluoruro de calcio con la cantidad adecuada de ácido sulfúrico
Solución


No hay comentarios:
Publicar un comentario