lunes, 20 de diciembre de 2021
ALDEHIDOS Y CETONAS ( TERCEROS) REALICE LA TAREA PROPUESTA
ALDEHIDOS Y CETONAS
Los aldehídos se nombran reemplazando la terminación -ano del alcano correspondiente por -al. No es necesario especificar la posición del grupo aldehído, puesto que ocupa el extremo de la cadena (localizador 1).
Cuando la cadena contiene dos funciones aldehído se emplea el sufijo -dial.
El grupo -CHO unido a un ciclo se llama -carbaldehído. La numeración del ciclo se realiza dando localizador 1 al carbono del ciclo que contiene el grupo aldehído.

Algunos nombres comunes de aldehídos aceptados por la IUPAC son:

Las cetonas se nombran sustituyendo la terminación -ano del alcano con igual longitud de cadena por -ona. Se toma como cadena principal la de mayor longitud que contiene el grupo carbonilo y se numera para que éste tome el localizador más bajo.

Existe un segundo tipo de nomenclatura para las cetonas, que consiste en nombrar las cadenas como sustituyentes, ordenándolas alfabéticamente y terminando el nombre con la palabra cetona.

Reactivo Limitante ( SEGUNDO ) REALICE LA TAREA PROPUESTA
Ejemplos de Reactivo Limitante
Por otra parte, los Reactivos en Exceso son aquellos que van a sobrar cuando el reactivo limitante se consuma completamente.
Sea la siguiente ecuación:
aX + bY → cZ. | |
Entonces los reactivos limitantes dependerán de las cantidades de reactivo presentes en la reacción:
b · moles de X < a · moles de Y → X es el reactivo limitante. | |
b · moles de X > a · moles de Y → Y es el reactivo limitante. | |
El concepto de Reactivo Limitante sirve para evitar costes innecesarios: el reactivo más caro será el limitante asegurando que se aprovecha lo máximo posible
- Ejemplo 1: sea la reacción de síntesis del metanol: CO + 2H2 → CH3OH.
Si se tienen 3 moles de CO y 5 moles de , calcular cuál es el reactivo limitante y la cantidad de metanol producida.
Calculamos cual es el reactivo limitante:
- b · moles de X = 2 · 3 = 6
- a · moles de Y = 1 · 5 = 5
Como b · moles X > a · moles Y → Y es el reactivo limitante, es decir el H2
La cantidad de metanol que se forma será por lo tanto:
- moles de Z = moles de Y · (c/b) = 5 · (1/2) = 2,5 moles de metanol
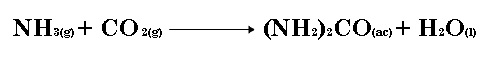
- Ejemplo 2: sea la reacción de síntesis de la urea: 2 NH3 + CO2 → (NH2)2CO + H2O
Si tenemos 500 gramos de NH3 y 1000 gramos de CO2 calculcular cuál es el reactivo limitante y la cantidad de urea producida.
Los pesos moleculares del NH3 , CO2 y (NH2)2CO son 17,03, 44,01 y 60,06 gramos/mol
Solución:
Calculamos en primer lugar cuántos moles hay de cada reactivo:
- moles NH3 = 500 gramos / 17,03 gramos · mol-1 = 29,36 moles
- moles CO2 = 1000 gramos / 44,01 gramos · mol-1 = 22,72 moles
Calculamos ahora cual es el reactivo limitante:
- b · moles de X = 1 · 29,36 = 29,36
- a · moles de Y = 2 · 22,72 = 45,44
Como b · moles X < a · moles Y → X es el reactivo limitante, es decir el NH3
Por último calculamos la cantidad de urea producida teniendo en cuenta el reactivo limitante:
- moles de urea producidos = moles de NH3 · (1/2) = 29,36 · (1/2) = 14,68 moles
- Peso urea = moles · peso molecular = 14,68 · 60,06 = 881,68 gramosTAREA
Si están presentes 100 gramos de cada uno de los reactivos, calcular cuál es el limitante y la cantidad sobrante del resto.
Los pesos moleculares del CH3OH, CH3Br y LiC4H9 son 32,04, 94,94 y 64,06 gramos/mol
Ejercicio 2: Sea la siguiente reacción: 2 Al + Fe2O3 → Al2O3 + 2 Fe
Si están presentes 100 gramos de cada uno de los reactivos, calcular cuál es el limitante, la cantidad sobrante del resto de reactivos y la cantidad de Al2O3 generada.Los pesos moleculares del Al, Fe2O3 y Al2O3 son 26,98, 159,69 y 101,96 gramos/mol respectivamente.
viernes, 17 de diciembre de 2021
Reactivo limitante y reactivo en exceso ( SEGUNDO) REALICE LA TAREA PROPUESTA
Reactivo limitante y reactivo en exceso
ACTIVIDAD DE REFLEXIÓN INICIAL:
Imaginemos que queremos hacer emparedados o sándwiches. Para un emparedado necesitamos 2 rebanadas de pan y 1 de jamón. Pensemos ahora que tenemos 20 rebanadas de pan y solamente 5 rebanadas de jamón.
a) ¿Cuántos emparedados podremos hacer?
|
b) ¿Por qué? Trata de hacer un análisis profundo y contesta argumentando.
|
c) ¿Cuál es el ingrediente que se termina primero?
|
d) ¿Cuál el ingrediente que tenemos en exceso?
|
A partir de la situación anterior, vamos a analizar dos conceptos muy importantes para el trabajo de un químico en situaciones reales que implican reacciones químicas.
a) El reactivo limitante es aquel del cual tenemos en menor cantidad y, por lo tanto, se terminará primero al momento de la reacción química, dando como resultado el final de la reacción, esto quiere decir que cuando se termine ya no se podrá seguir generando cierto producto. En el caso anterior, el reactivo limitante es el jamón, ya que al terminarse no se pueden seguir haciendo más emparedados.
b) El reactivo en exceso es aquel del cual tenemos más de lo necesario para que se lleve a cabo la reacción química. En el caso de los emparedados, el reactivo en exceso son las rebanadas de pan, ya que sólo se utilizaron 10 rebanadas para los únicos 5 emparedados que se pudieron hacer.
Debido a la presencia del reactivo limitante, podemos decir que las reacciones van a estar “limitadas” por éste, por lo cual cuando vayamos a obtener la cantidad de cierto producto tenemos que partir del reactivo limitante para poder sacar la cantidad de producto correcta.
EJEMPLOS
1.- A altas temperaturas el azufre se combina con el hierro para formar el sulfato de hierro (II) café oscuro:
En un experimento 7.621 g de Fe se dejan reaccionar con 8.669 g de S.
a) ¿Cuál de los dos es el reactivo limitante?
Antes de cualquier otra cosa, es conveniente sacar las masas teóricas de los reactivos y del producto. Después de eso, procedemos a anotar las masas reales dadas.
Para proceder a conocer cuál es el reactivo limitante, vamos a evaluar los dos reactivos y ver cuál de los dos producen menos FeS, el cual será el reactivo limitante.
b) Calcula la masa de FeS formada.
La ventaja de utilizar el método anterior, es que ya nos da la masa directamente del FeS.
Respuesta: 11.988 g= 12 g de FeS.
c) ¿Qué cantidad del reactivo excedente (en g) queda al final de la reacción?
Sabemos por el procedimiento anterior que el reactivo en exceso es el azufre. Por lo cual, necesitamos evaluar la cantidad de azufre que necesita para reaccionar nuestra cantidad de hierro inicial:
.TAREA
CONTESTE LAS PREGUNTAS DE INICIO
Resuelve el siguiente problema.
La UREA [(NH2)2CO] se usa como fertilizante, como alimento para animales y en la industria de los polímeros. Se prepara por reacción del amoniaco con el dióxido de carbono:
En cierto proceso, se hacen reaccionar 637.3 g de NH3 con 1141 g de CO2. a) ¿Cuál de los dos reactivos es el limitante?
b) Calcular la masa de (NH2)2CO formada.
c) ¿Qué cantidad del reactivo excedente (en g) queda al finalizar la reacción?
|



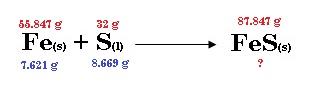


Los Oxoácidos son compuestos poliatómicos (varios átomos) integrados por el oxígeno, un elemento generalmente no metálico y el hidrógeno.
La fórmula general de los oxoácidos es
H NO METAL O
Donde el hidrógeno actúa con estado de oxidación +1 hace referencia a la parte electropositiva del compuesto, mientras que el oxígeno, que actúa con estado de oxidación -2, y el elemento no metálico (generalmente) constituyen la parte electronegativa del mismo.
Nomenclatura tradicional: se nombra con la palabra ácido seguido de la raíz del elemento no metálico e indicando la valencia con la que actúa según el siguiente criterio.
La Nomenclatura de stock: comienza con la palabra ácido (lo cual hace referencia a la parte electropositiva, el hidrógeno), seguido del prefijo que indica el número de oxígenos más la palabra “oxo” y por último el prefijo que indica el número de átomos del elemento no metálico (generalmente 1) seguido de la raíz del elemento no metálico terminado en “ico” y en números romanos indicamos su valencia.
Nomenclatura sistemática: comienza con el prefijo que indica el número de oxígenos seguido de la palabra “oxo” seguido del prefijo que indica el número de átomos del elemento no metálico, y la raíz del elemento no metálico acabado en “ato”, en números romanos indicamos la valencia del elemento no metálico. Finalmente añadimos por último las palabras «de hidrógeno«.
* Cuando sólo tenemos un oxígeno no se indica el prefijo mono.
Además de estos tenemos:
– El prefijo “piro” hace alusión a la formación del ácido a partir de la unión del anhídrido con dos moléculas de agua.
– Sería el prefijo “meta” se corresponde a cuando la formación del ácido se debe a la unión de una sola molécula de agua (lo más normal).