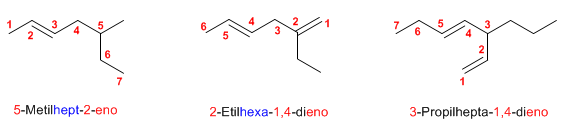
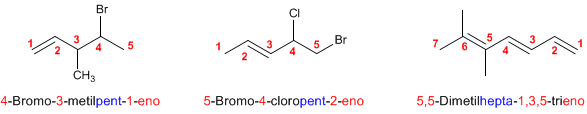
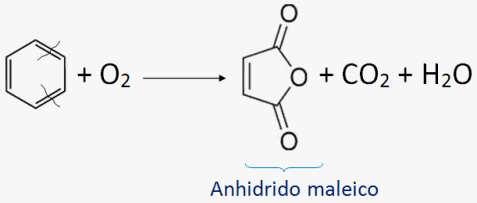
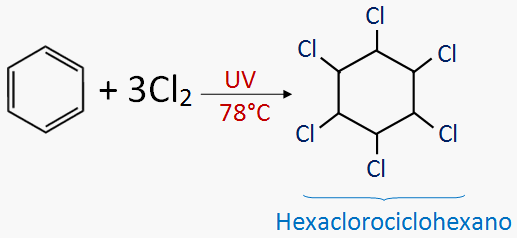
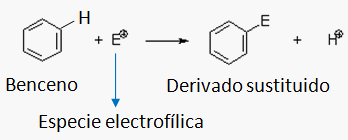
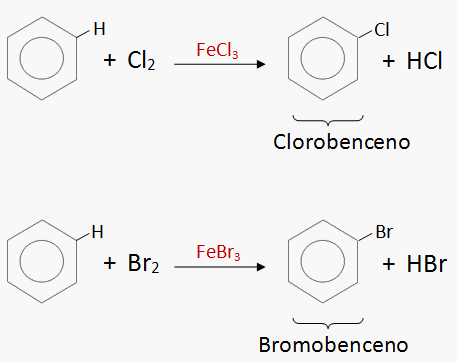
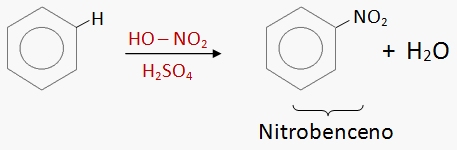
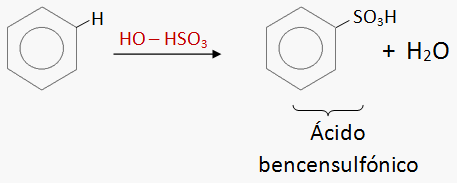
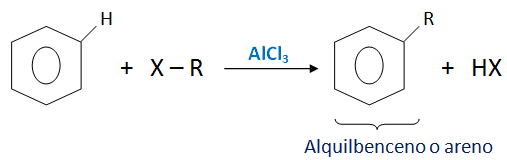
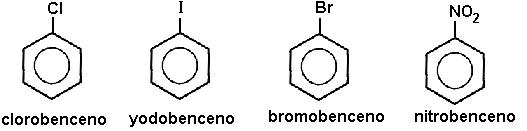
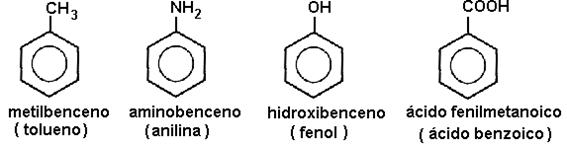
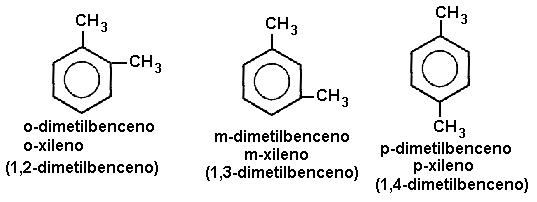
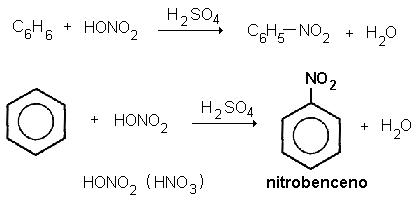
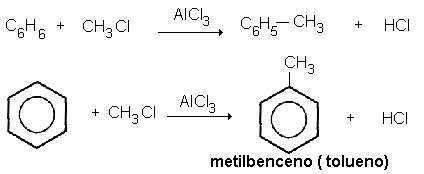
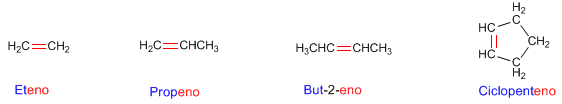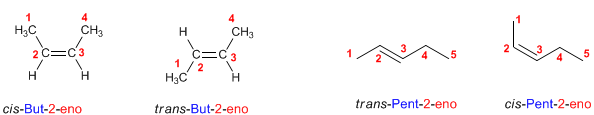FLUJO ENERGÉTICO
Los organismos puede ser productores o consumidores en cuanto al flujo de energía a través de un ecosistema. Los productores
convierten la energía ambiental en enlaces de carbono, como los
encontrados en el azúcar glucosa. Los ejemplos más destacados de
productores son las plantas; ellas usan, por medio de la
fotosíntesis, la energía de la luz solar para convertir el dióxido de
carbono en glucosa (u otro azúcar). Las algas y las cianobacterias
también son productores fotosintetizadores, como las plantas.
Otros productores son las bacterias que viven en algunas profundidades
oceánicas. Estas bacterias toman la energía de productos químicos
provenientes del interior de la Tierra y con ella producen azúcares.
Otras bacterias que viven bajo tierra también pueden producir azúcares
usando la energía de sustancias inorgánicas. Otro término para
productores es autótrofos.
Los consumidores obtienen su energía de los enlaces de carbono originados por los productores. Otro término para un consumidor es heterótrofo. Es posible distinguir 4 tipos de heterótrofos en base a lo que comen:
| Consumidor | Nivel trófico | Fuente alimenticia |
|---|---|---|
| 1. Herbívoros | primario | plantas |
| 2. Carnívoros | secundario o superior | animales |
| 3. Omnívoros | todos los niveles | plantas y animales |
| 4. Detritívoros | --------------- | detrito |
El nivel trófico se
refiere a la posición de los organismos en la cadena alimenticia,
estando los autótrofos en la base. Un organismo que se alimente de
autótrofos es llamado herbívoro o consumidor primario; uno que coma herbívoros es un carnívoro o consumidor secundario. Un carnívoro que coma carnívoros que se alimentan de herbívoros es un consumidor terciario, y así sucesivamente.
Es importante observar que muchos animales no tienen dietas especializadas. Los omnívoros
(como los humanos) comen tanto animales como plantas. Igualmente, los
carnívoros (excepto algunos muy especializados) no limitan su dieta sólo
a organismos de un nivel trófico. Las ranas y sapos, por ejemplo, no
discriminan entre insectos herbívoros y carnívoros; si es del tamaño
adecuado y se encuentra a una distancia apropiada, la rana lo capturará
para comérselo sin que importe el nivel trófico.
Flujo de Energía a través del Ecosistema

El diagrama anterior muestra como la energía
(flechas oscuras) y los nutrientes inorgánicos (flechas claras) fluyen a
través del ecosistema. Debemos, primeramente, aclarar algunos
conceptos. La energía "fluye" a través del ecosistema como enlaces
carbono-carbono. Cuando ocurre respiración, los enlaces carbono-carbono
se rompen y el carbono se combina con el oxígeno para formar dióxido de
carbono (CO2). Este proceso libera energía, la que es usada
por el organismo (para mover sus músculos, digerir alimento, excretar
desechos, pensar, etc.) o perdida en forma de calor. Las flechas oscuras
en el diagrama representa el movimiento de esta energía. Observe que
toda la energía proviene del sol, y que el destino final de toda la
energía es perderse en forma de calor. ¡La energía no se recicla en los ecosistemas!
Los nutrientes inorgánicos son el otro componente
mostrado en el diagrama. Ellos son inorgánicos debido a que no
contienen uniones carbono-carbono. Algunos de estos nutrientes
inorgánicos son el fósforo en sus dientes, huesos y membranas celulares;
el nitrógeno en sus aminoácidos (las piezas básicas de las proteínas); y
el hierro en su sangre (para nombrar solamente unos pocos nutrientes
inorgánicos). El flujo de los nutrientes se representa con flechas
claras. Observe que los autótrofos obtienen estos nutrientes inorgánicos
del 'almacen' de nutrientes inorgánicos (usualmente el suelo o el agua
que rodea la planta). Estos nutrientes inorgánicos son pasados de
organismo a organismo cuando uno es consumido por otro. Al final, todos
los organismos mueren y se convierten en detrito, alimento para los
descomponedores. En esta etapa, la energía restante es extraida (y
perdida como calor) y los nutrientes inorgánicos son regresados al suelo
o agua para se utilizados de nuevo. Los nutrientes inorgánicos son reciclados, la energía no.
Para resumir: En el flujo de energía y de nutrientes inorgánicos, es posible hacer algunas generalizaciones:
- La fuente primaria (en la mayoría de los ecosistemas) de energía es el sol.
- El destino final de la energía en los ecosistemas es perderse como calor.
- La energía y los nutrientes pasan de un organismo a otro a
través de la cadena alimenticia a medida que un organismo se come a
otro.
- Los descomponedores extraen la energía que permanece en los restos de los roganismos.
- Los nutrientes inorgánicos son reciclados pero la energía no.
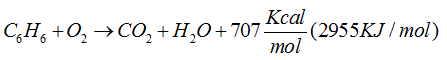
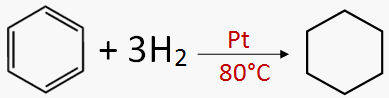


















 tá
compuesto esencialmente por la cabeza, donde se aloja la información
genética que será transmitida a los hijos, el cuerpo, que sirve de
ensamble entre la cola y la cabeza, la cola, que le otorga movilidad y
le permite trasladarse por el aparato reproductor femenino en busca del
óvulo y la pieza terminal.
tá
compuesto esencialmente por la cabeza, donde se aloja la información
genética que será transmitida a los hijos, el cuerpo, que sirve de
ensamble entre la cola y la cabeza, la cola, que le otorga movilidad y
le permite trasladarse por el aparato reproductor femenino en busca del
óvulo y la pieza terminal.